【侯氏制碱法】化学:侯氏制碱法方程式?_化学_众神小三492
编辑: admin 2017-15-06
-
4
侯氏制碱法又名联合制碱法
(1)NH3+H2O+CO2=NH4HCO3
(2)NH4HCO3+NaCl=NH4Cl+NaHCO3↓
(3)2NaHCO3(加热)=Na2CO3+H2O+CO2↑
即:①NaCl(饱和溶液)+NH3(先加)+H2O(溶液中)+CO2(后加)=NH4Cl+NaHCO3↓ (溶解度一般,因为不断添加原料达到溶液饱和才沉淀)
②2NaHCO3(加热)=Na2CO3+H2O+CO2↑
优点 保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到 96 %; NH4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2 ,革除了 CaCO3 制 CO2 这一工序.
其他同学给出的参考思路:
(1)NH3+H2O+CO2=NH4HCO3
(2)NH4HCO3+NaCl=NH4Cl+NaHCO3↓
(3)2NaHCO3(加热)=Na2CO3+H2O+CO2↑
互助这道作业题的同学还参与了下面的作业题
题1: 太奇怪了,侯氏制碱法那个方程式不对呀CO2+NH3*H2O=NH4HCO3这应该是个中和反应吧?可中和反应属于复分解反应,复分解反应怎么可能只生成一种物质呢?我的想法是CO2溶于水形成了H2CO3,NH3溶于水形[化学科目]
你的分析基本是正确的.主要问题有:没有NH4OH这种物质;(NH4)2CO3也应该不会稳定存在.(从离子间相互作用力的分析可以得出,虽然很多资料上写出了该物质,只是说明编书者的水平还不够).
有关反应如下:
1.NH3+H2O==NH3*H2O
2.CO2+H2O==H2CO3
3.H2CO3+NH3*H2O===NH4HCO3+H2O
总反应为:
NH3+H2O+CO2===NH4HCO3
从电离理论看只有3是中和反应.从酸碱质子理论来看总反应也是中和反应.
本人学识有限,还望有高手指正.
题2: 【化学侯氏制碱法的第一个反应方程式为什么会反应?】[化学科目]
第一步反应是
NH3+CO2+H2O === NH4HCO3
氨气是碱性气体,二氧化碳是酸性气体,两者在水中生成盐碳酸氢铵
题3: 化学问题(关于侯氏制碱法)侯氏制碱法中的副产品有什么用途?而且向母液中通入氨气,加入细小食盐颗粒,冷却析出副产品,通入氨气的作用是什么?[化学科目]
同意楼上的说法.但我要补充几点.
关于加入氨气的作用.
若不加氨气,由于CO2在水中的溶解度较小,不能生成足够溶度的NaHCO3使其沉淀.
加了氨气后,CO2先与氨气反应生成NH4CO3,增大了CO2溶解的量,利用NaHCO3的溶解度比NH4CO3的小,在溶液中的HCO3-达到一定程度后就先与Na+结合产生NaHCO3的沉淀.
总而言之,加氨就是吸收更多的CO2,而不影响NaHCO3的沉淀.另外的好处请看楼上的或中学化学书.
题4: 侯氏制碱法的步骤及方程式
侯氏制碱法又名联合制碱法
(1)NH3+H2O+CO2=NH4HCO3
(2)NH4HCO3+NaCl=NH4Cl+NaHCO3↓
(3)2NaHCO3(加热)=Na2CO3+H2O+CO2↑
即:①NaCl(饱和溶液)+NH3(先加)+H2O(溶液中)+CO2(后加)=NH4Cl+NaHCO3↓ (溶解度一般,因为不断添加原料达到溶液饱和才沉淀)
②2NaHCO3(加热)=Na2CO3+H2O+CO2↑
优点 保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到 96 %; NH4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2 ,革除了 CaCO3 制 CO2 这一工序.
题5: 【〈侯氏制碱法〉关于高中化学的包括原理,反应化学方程式等.】[化学科目]
侯氏制碱法
[编辑本段]侯氏制碱法
(联合制碱法)
(1)NH3+H2O+CO2=NH4HCO3
(2) NH4HCO3+NaCl=NH4Cl+NaHCO3↓
(3)2NaHCO3=加热=Na2CO3+H2O+CO2↑
即:①NaCl(饱和)+NH3+H2O+CO2=NH4Cl+NaHCO3↓
②2NaHCO3=加热=Na2CO3+H2O+CO2↑
氨气与水和二氧化碳反应生成一分子的碳酸氢铵,这是第一步.第二步是:碳酸氢铵与氯化钠反应生成一分子的氯化铵和碳酸氢钠沉淀,碳酸氢钠之所以沉淀是因为他的溶解度较小.
根据 NH4Cl 在常温时的溶解度比 NaCl 大,而在低温下却比 NaCl 溶解度小的原理,在 278K ~ 283K(5 ℃~ 10 ℃ ) 时,向母液中加入食盐细粉,而使 NH4Cl 单独结晶析出供做氮肥.
此法优点:保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到 96 %; NH4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2 ,革除了 CaCO3 制 CO2 这一工序.
碳酸钠用途非常广泛.虽然人们曾先后从盐碱地和盐湖中获得碳酸钠,但仍不能满足工业生产的需要.
1862年,比利时人索尔维(Ernest Solvay 1838—1922)发明了以食盐、氨、二氧化碳为原料制取碳酸钠的“索尔维制碱法”(又称氨碱法).此后,英、法、德、美等国相继建立了大规模生产纯碱的工厂,并组织了索尔维公会,对会员以外的国家实行技术封锁.
第一次世界大战期间,欧亚交通梗塞.由于我国所需纯碱都是从英国进口的,一时间,纯碱非常缺乏,一些以纯碱为原料的民族工业难以生存.1917年,爱国实业家范旭东在天津塘沽创办了永利碱业公司,决心打破洋人的垄断,生产出中国的纯碱.他聘请正在美国留学的侯德榜先生出任总工程师.
1920年,侯德榜先生毅然回国任职.他全身心地投入制碱工艺和设备的改进上,终于摸索出了索尔维法的各项生产技术.1924年8月,塘沽碱厂正式投产.1926年,中国生产的“红三角”牌纯碱在美国费城的万国博览会上获得金质奖章.产品不但畅销国内,而且远销日本和东南亚.
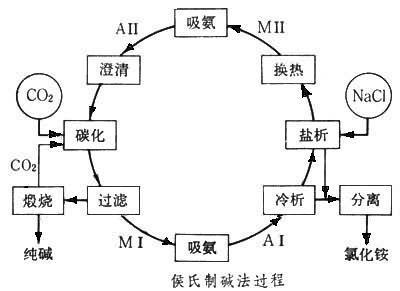
针对索尔维法生产纯碱时食盐利用率低,制碱成本高,废液、废渣污染环境和难以处理等不足,侯德榜先生经过上千次试验,在1943年研究成功了联合制碱法.这个新工艺是把氨厂和碱厂建在一起,联合生产.由氨厂提供碱厂需要的氨和二氧化碳.母液里的氯化铵用加入食盐的办法使它结晶出来,作为化工产品或化肥.食盐溶液又可以循环使用.为了实现这一设计,在1941一1943年抗日战争的艰苦环境中,在侯德榜的严格指导下,经过了500多次循环试验,分析了2000多个样品后,才把具体工艺流程定下来,这个新工艺使食盐利用率从70%一下子提高到96%,也使原来无用的氯化钙转化成化肥氯化铵,解决了氯化钙占地毁田、污染环境的难题.这方法把世界制碱技术水平推向了一个新高度,赢得了国际化工界的极高评价.1943年,中国化学工程师学会一致同意将这一新的联合制碱法命名为“侯氏联合制碱法”.所谓“联合制碱法”中的“联合”,指该法将合成氨工业与制碱工业组合在一起,利用了生产氨时的副产品CO2,革除了用石灰石分解来生产,简化了生产设备.此外,联合制碱法也避免了生产氨碱法中用处不大的副产物氯化钙,而用可作化肥的氯化铵来回收,提高了食盐利用率,缩短了生产流程,减少了对环境的污染,降低了纯碱的成本.联合制碱法很快为世界所采用.
侯氏制碱法的原理是依据离子反应发生的原理进行的,离子反应会向着离子浓度减小的方向进行.也就是很多初中高中教材所说的复分解反应应有沉淀,气体和难电离的物质生成.他要制纯碱(Na2CO3),就利用NaHCO3在溶液中溶液中溶解度较小,所以先制得NaHCO3.再利用碳酸氢钠不稳定性分解得到纯碱.要制得碳酸氢钠就要有大量钠离子和碳酸氢根离子,所以就在饱和食盐水中通入氨气,形成饱和氨盐水,再向其中通入二氧化碳,在溶液中就有了大量的钠离子,铵根离子,氯离子和碳酸氢根离子,这其中NaHCO3溶解度最小,所以析出,其余产品处理后可作肥料或循环使用.