【酸的酸性与什么有关】酸性强弱和什么有关_化学_ocy449
编辑: admin 2017-15-06
-
4
酸性是由溶液中游离态的氢离子物质的量浓度来决定的.
溶液中是醋酸,则加入醋酸越多,氢离子浓度也就越大,因此酸性也就越强.
浓度大的弱酸的酸性是可以大于浓度小的强酸的.
互助这道作业题的同学还参与了下面的作业题
题1: 如何比较酸性强弱是原子半径越小酸性越强吗?如果是,那么为什么C的半径比P小它的含氧酸酸性还比P弱啊[化学科目]
无机酸只能在同周期或同主族进行比较,才有意义.
1.同周期,第二周期从B,C,N原子半径递减,这样最高价含氧酸酸性 H3BO3(极弱酸)HBrO4(强酸)>HIO4(中强酸))
题2: 列举常见的酸.并说明酸性强弱关系.硅酸呢?
HClO4>HI>HBr≈H2SO4>HCl>HClO3>HNO3(以上为强酸)>H2C2O4(草酸)>H2SO3>H3PO4>CH3COCOOH(丙酮酸)>HNO2(以上为中强酸)>HF>HCOOH>C3H6O3(乳酸)>C6H5COOH(苯甲酸)>CH2=CH-COOH(丙烯酸)>CH3COOH>C2H5COOH(丙酸)>C17H33COOH(油酸)>C17H35COOH(硬脂酸)>H2CO3>H2S>HClO>H3BO3>H2SiO3>C6H5OH(苯酚)
以上为常见酸的酸性,我都仔细查过资料了.
如果你上高中,这些就够用了,如有需要我给你补充!
题3: 【比较酸性强弱HF酸性小于HCl酸性小于HBr酸性,随非金属性的减弱,酸性增强,但是C的非金属性比Si强,为什么H2CO3酸性大于H2SiO3酸性?同时Cl的非金属性比Si强,为什么盐酸酸性比硅酸酸性强?我说错了】[化学科目]
1.比较元素金属性强弱的方法
(1)根据原子结构
原子半径(电子层数)越大,最外层电子数越少,金属性越强,反之越弱.
(2)根据在周期表中的位置
a.同周期元素,从左至右随原子序数的增加,金属性减弱,非金属性增强;
b.同主族元素,从上至下,随原子序数的增加,金属性增强,非金书性减弱.
(3)根据金属活动性顺序表
金属性位置越靠前,其金属性越强.
(4)根据实验
a.根据金属单质与水(或酸)的反应的难易程度;越易反应,则对应得元素的金属性越强.
b.根据金属单质与盐溶液的置换反应,这个不用多说……
c.根据金属单质的还原性或对应阳离子的氧化性强弱:单质的还原性越强,对应阳离子的氧化性越弱,元素的金属性越强(Fe对应的是Fe2+而不是Fe3+)
d.根据最高价氧化物对应水化物的碱性强弱:碱性越强,则金属性越强.
e.根据电化学原理:不同金属形成原电池时,作负极的金属活泼;在电解池中的惰性电极上,先析出的金属不活泼.
2.比较元素非金属性强弱的方法
⑴根据原子结构
原子半径(电子层数)越小,最外层电子数越多,非金属性越强,反之越弱.
⑵根据在周期表中的位置
①同周期元素,从左至右,随原子序数的增加,非金属性增强
②同主族元素,从上至下,随原子序数的增加,非金书性减弱.
⑶根据实验
①根据非金属单质与H2化合的难易程度:越易化合则非金属性越强.
②根据形成的氢化物的稳定性或还原性:越稳定或还原性越弱,则其对应元素的非金属越强
③根据非金属间的相互置换:A能置换出B,则A对应的非金属元素的非金属性强于B对应的非金属元素的非金属性.
④根据最高价氧化物对应水化物的酸性强弱:酸性越强,则非金属性越强.
⑤根据非金属单质的氧化性或对应阴离子的还原性强弱:单质的氧化性越强,其对应阴离子的还原性越弱,非金属性越强.
题4: 【酸性强弱的比较H2SO3,H3PO4,HCOOH,HF,CH3COOH,H2CO3,HCLO,H2SIO3的强弱】[数学科目]
酸性顺序:
H2SO3 > H3PO4 > HF > HCOOH > CH3COOH > H2CO3 > HCLO > H2SIO3
常数在图片里...
数据来自<<无机化学>>--武大,吉大合编(第三版) 高教出版社
希望对版主有帮助.
:-)
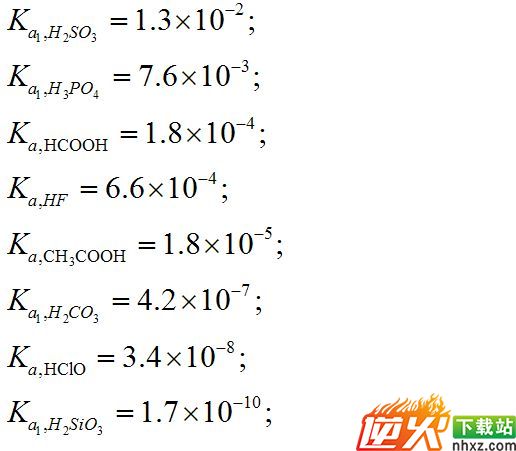
题5: 酸性强弱比较问一些酸酸性的大致比较标准1、同种价态元素,含有过氧键的酸比没有过氧键的酸酸性强么(比如硫酸、过一硫酸、过二硫酸)2、原酸酸性比偏酸来说怎么样?【比如钒酸(含VO2+[化学科目]
1.这个很难说,我在兰氏化学手册查到过一硫酸比硫酸弱,但过一磷酸比磷酸强.数据如下
pK
H2SO4 -3 2.0
H2SO5 1.0 9.3
H3PO4 2.2 7.2 12.4
H3PO5 1.1 5.5 12.8
过二硫酸没见到数据,应该比过一硫酸还弱.
2.一般原酸的酸性弱于正酸弱于偏酸,H3PO4弱于HPO3、H5IO6弱于HIO4
3.同多酸往往比单酸强,H4P2O7强于H3PO4、H2B4O7强于H3BO3.硅酸说不清,从来都没有各类硅酸的电离常数数据.
至于多酸和偏酸难以比较.例如H5P3O10 > HPO3 > H4P2O7
4.杂多酸酸性比单酸强,与同多酸难以比较,一般是在两个组分相应的同多酸之间,但也有一些杂多酸酸性显著强于相应同多酸.
