【分子空间构性】O3分子空间构型为什么是V型 如何判断 请详细解答 谢啦_化学_娜娜喏212
编辑: admin 2017-15-06
- 追问:
根据价电子理论模型能判断么
互助这道作业题的同学还参与了下面的作业题
题1: 臭氧的分子构型,懂分子轨道的进臭氧中为什么离域π键中,为什么是一个π3、4,而不是两个π3、5[化学科目]
中间的O是sp2杂化,
两侧的O各提供一个垂直于平面且包含一个电子的p轨道,之所以不是两个电子的p轨道,是因为电子数越多,体系能量就越高,越不稳定
题2: 臭氧的分子构型是什么样的?是怎样成键的?[化学科目]
中心氧原子 sp2杂化,有一对孤对电子. 臭氧为极性分子,偶极矩 0.53 D.其极性可以用下图中的共振式说明,中间的氧与两端的氧原子之间的键级为1.5.中心的氧原子带有部分正电.
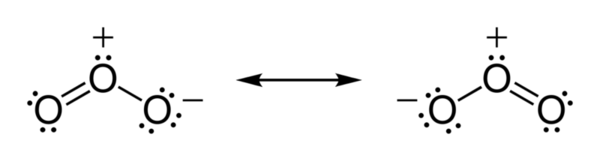
题3: 解释NO2+,O3,SnCl3-,OF2,ICl3,I3-,XeF5+,ICl4-等离子或分子的空间构型,并指出其中心原子的轨道杂(的杂化方式)落下了···[化学科目]
NO2+,sp 直线型
O3,sp2 V型
SnCl3-,不等性sp3 三角锥型
OF2,不等性sp3 V型
ICl3,sp3d杂化 T型
I3-,sp3d杂化 直线型
XeF5+,sp3d2杂化 四角锥形
ICl4- sp3d2杂化 平面正方形
题4: 分子的空间构型15、若ABn的中心原子上有一对孤对电子未能成键,当n=2时,其分子结构为;当n=3时,其分子结构为.16、1994年度诺贝尔化学奖授予为研究臭氧做出特殊贡献的化学家.
15.角形,采用sp2杂化;伞形(或三角椎),采用sp3杂化
16.CDE(均是sp2杂化)CE(它们是三原子18电子等电子体)
17.(1)H:O:O:H, 然后再在每个氧上下各点两个点
(2)3个西格玛键(两个氢氧键、一个氧氧键)
(3)过氧化氢是极性分子不溶于非极性溶剂
(4)-1,其中有一个氧氧键(即过氧键)
(5)2,sp3,109.5度,孤对电子排斥力大,使键角减小,长(也是孤对电子的排斥作用)
18.(1)CO2(等电子体),直线,sp
(2)AB3,24,SO3,平面三角,sp2
(3):N::N::O:,然后氮(左)上氧上各两个点,直线
19.见图,sp3或sp2,成西格玛键或派键(羰基)
题5: H2O2PCl3PCl5三个分子空间构型如何,分子极性如何?高人告诉下谢谢
纠正一下,H2O2绝对不是直线型,不要被无知的人误导
它形成的是类似书页型的结构,就像一本打开的书,两个O在书脊上,两个氢分别伸到两片书页上.不仅不是一直线,而且不共面.
PCl3是三角锥形,类似氨分子
PCl5是三角双锥,2L讲得差不多.
-
4
价层电子对互斥理论,简称VSEPR
用于判断共价分子的构型,简便、实用且与实验事实相吻合
基本要点请查书本(AXmLn的分子,计算中心原子A的价层电子对数VPN=0,5*(A的价电子数+X提供的价电子数+离子电荷),配位原子X为O或者S时当作不提供共用电子处理,X提供的价电子数记为0,另外,如果X为H或者卤素时,则记为1)
O3分子中一个O为中心原子,成键后其仍有一对孤对电子.
其价层电子对数:VPN=(6+0*2)/2=3 分子类型属于AX2L1
则从几何构型与价层电子对的排布方式简表,可得O3分子构型为V形
其他同学给出的参考思路:
看看电子式
